REG 174 INFORMACIÓN PARA PROFESIONALES DE LA SALUD DEL REINO UNIDO
Este medicamento no tiene una autorización de comercialización en el Reino Unido, pero el Departamento de Salud y Asistencia Social del Reino Unido y la Agencia Reguladora de Medicamentos y Productos Sanitarios han autorizado su suministro temporal para la inmunización activa para prevenir la enfermedad COVID-19 causada por el SARS-CoV- 2 en individuos de 16 años de edad o más.
Al igual que con cualquier medicamento nuevo en el Reino Unido, este producto será monitoreado de cerca para permitir una identificación rápida de nueva información sobre seguridad. Se invita a los profesionales de la salud a notificar cualquier sospecha de reacciones adversas.
Consulte la sección 4.8 para saber cómo notificar las reacciones adversas.
¡SÚMATE A NUESTRA COMUNIDAD!
1.NOMBRE DEL MEDICAMENTO:
Vacuna COVID-19 mRNA BNT162b2 concentrado para solución inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Este es un vial multidosis y debe diluirse antes de su uso. 1 vial (0,45 ml) contiene 5 dosis de 30 microgramos de BNT162b2RNA (incrustado en nanopartículas lipídicas).
La vacuna de ARNm de COVID-19 BNT162b2 es ARN mensajero (ARNm) monocatenario con tapa 5′ altamente purificado, producido por transcripción libre de células en transcripción in vitro a partir de las plantillas de ADN correspondientes, que codifica la proteína de la espícula (S) viral del SARS-CoV-2.
Efecto conocido: Para la lista completa de excipientes, ver sección 6.1.3
3. FORMA FARMACÉUTICA
Concentrado para solución inyectable.
La vacuna es una solución congelada de color blanco a blanquecino
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Inmunización activa para prevenir el COVID-19 causado por el virus del SARS-CoV-2, en personas de 16 años o más.
El uso de la vacuna de ARNm de COVID-19 BNT162b2 debe realizarse de acuerdo con las recomendaciones oficiales.
4.2. Posología y forma de administración
Posología
Personas de 16 años de edad y mayores.
La vacuna de ARNm de COVID-19 BNT162b2 se administra por vía intramuscular después de la dilución en una serie de dos dosis (0,3 ml cada una) con una separación de 21 días (ver sección 5.1).
No hay datos disponibles sobre la intercambiabilidad de la vacuna de ARNm de COVID-19 BNT162b2 con otras vacunas de COVID-19 para completar la serie de vacunación. Las personas que han recibido una dosis de la vacuna de ARNm de COVID-19 BNT162b2 deben recibir una segunda dosis de la vacuna de ARNm de COVID-19 BNT162b2 para completar la serie de vacunación.
Es posible que las personas no estén protegidas hasta al menos 7 días después de su segunda dosis de la vacuna.
Para más información sobre la eficacia, ver sección 5.1
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de la vacuna de ARNm de COVID-19 BNT162b2 en niños menores de 16 años.
Forma de administración
Administrar la vacuna de ARNm de COVID-19 BNT162b2 por vía intramuscular en el músculo deltoides después de la dilución. No inyectar la vacuna por vía intravascular, subcutánea o intradérmica.
Preparación: El vial multidosis se almacena congelado y debe descongelarse antes de la dilución.

Los viales congelados deben transferirse de 2 °C a 8 °C para descongelarlos; un envase de 195 viales puede tardar 3 horas en descongelarse (ver sección 6.4). Alternativamente, los viales congelados también se pueden descongelar durante 30 minutos a temperaturas de hasta 25 °C para su uso inmediato. Una vez descongeladas, la vacuna sin diluir se puede almacenar hasta 5 días entre 2 °C y 8 °C, y hasta 2 horas a temperaturas hasta 25 °C.
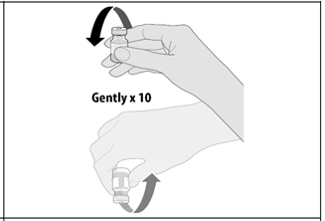
Deje que el vial descongelado alcance la temperatura ambiente e invierta suavemente 10 veces antes de la dilución. No agitar. Antes de la dilución, la vacuna debe presentarse como una solución blanquecina sin partículas visibles. Deseche la vacuna si hay partículas o decoloración.
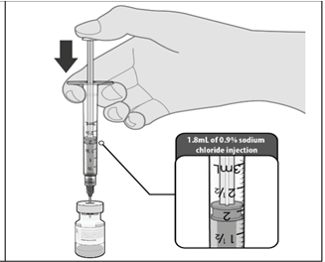
La vacuna descongelada debe diluirse en su vial original con 1,8 ml de solución inyectable de cloruro de sodio 9 mg / ml (0,9%), utilizando una aguja de calibre 21 o más estrecha y técnicas asépticas.
Advertencia: Solución de cloruro de sodio sin conservantes 9 mg / ml (0,9%) para La inyección es el único diluyente que debe usarse. Este diluyente no se incluye en la caja de la vacuna.
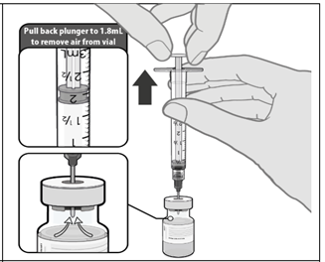
Equilibre la presión del vial antes de retirar la aguja del vial extrayendo 1,8 ml de aire en la jeringa de diluyente vacía.

Invierta suavemente la solución diluida 10 veces. No agitar.
La vacuna diluida debe presentarse como una solución blanquecina sin partículas visibles. Desechar la vacuna diluida si se presentan partículas o decoloración.
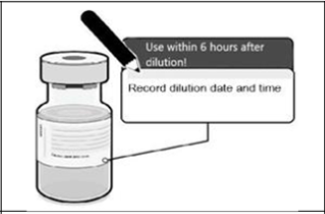
Los viales diluidos deben marcarse con la fecha y la hora de dilución y almacenarse entre 2 °C y 25 °C.
Usar inmediatamente y dentro de las 6 horas posteriores a la dilución.
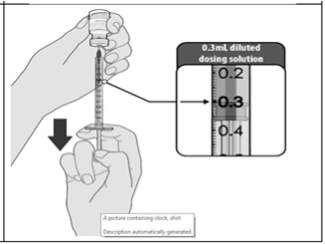
Después de la dilución, el vial contiene 5 dosis de 0,3 ml. Extraiga la dosis necesaria de 0,3 ml de vacuna diluida con una aguja y una jeringa estériles y deseche cualquier vacuna no utilizada dentro de las 6 horas posteriores a la dilución.
Para obtener instrucciones sobre la eliminación, ver sección 6.6.4.3
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Trazabilidad
Con el fin de mejorar la trazabilidad de los medicamentos biológicos, se debe registrar claramente el nombre y el número de lote del producto administrado
Recomendaciones generales
Como con todas las vacunas inyectables, el tratamiento médico y la supervisión adecuados siempre deben estar fácilmente disponibles en caso de un evento anafiláctico poco común después de la administración de la vacuna.
La administración de la vacuna de ARNm de COVID-19 BNT162b2 debe posponerse en personas que padecen enfermedad febril aguda grave.Las personas que reciben terapia anticoagulante o aquellas con un trastorno hemorrágico que contraindicaría la inyección intramuscular, no deben recibir la vacuna a menos que el beneficio potencial supere claramente el riesgo.
Las personas inmunodeprimidas, incluidas las personas que reciben terapia inmunosupresora, pueden tener una respuesta inmunitaria disminuida a la vacuna. No hay datos disponibles sobre el uso concomitante de inmunosupresores.
Como con cualquier vacuna, la vacunación con la vacuna BNT162b2 de ARNm de COVID-19 puede no proteger a todos los receptores de la vacuna.
No se dispone de datos sobre el uso de la vacuna de ARNm de COVID-19 BNT162b2 en personas que hayan recibido previamente una serie de vacunas completa o parcial con otra vacuna de COVID-19.
Información sobre el excipiente
Esta vacuna contiene potasio, menos de 1 mmol (39 mg) por dosis, es decir, esencialmente ‘ libre de potasio ‘. Esta vacuna contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, esencialmente «libre de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción
No se ha estudiado la administración concomitante de la vacuna de ARNm de COVID-19 BNT162b2 con otras vacunas (ver sección 5.1).
No mezclar la vacuna de ARNm de COVID-19 BNT162b2 con otras vacunas / productos en la misma jeringa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o son limitados sobre el uso de COVID-19 mRNAVaccine BNT162b2. No se han completado los estudios de toxicidad reproductiva en animales.
No se recomienda la vacuna COVID-19 mRNA BNT162b2 durante el embarazo. Para las mujeres en edad fértil, se debe descartar el embarazo antes de la vacunación. Además, se debe advertir a las mujeres en edad fértil que eviten el embarazo durante al menos 2 meses después de la segunda dosis.
Lactancia
Se desconoce si la vacuna de ARNm de COVID-19 BNT162b2 se excreta en la leche materna. No se puede excluir un riesgo para los recién nacidos / lactantes. No se debe utilizar la vacuna de ARNm de COVID-19 BNT162b2 durante la lactancia.
Fertilidad
No se sabe si la vacuna de ARNm de COVID-19 BNT162b2 tiene un impacto en la fertilidad
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La vacuna de ARNm de COVID-19 BNT162b2 tiene una influencia nula o insignificante sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunas de las reacciones adversas mencionadas en la sección 4.8 pueden afectar temporalmente a la capacidad para conducir o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
La seguridad de la vacuna de ARNm de COVID-19 BNT162b2 se evaluó en participantes de 16 años o más en dos estudios clínicos realizados en Estados Unidos, Europa, Turquía, Sudáfrica y América del Sur. El estudio BNT162-01 (Estudio 1) reclutó a 60 participantes, de 18 a 55 años de edad. El estudio C4591001 (estudio 2) reclutó aproximadamente a 44.000 participantes, de 12 años de edad o más. En el Estudio 2, un total de 21.720 participantes de 16 años de edad o más recibieron al menos una dosis de la vacuna de ARNm de COVID-19 BNT162 y 21.728 participantes de 16 años de edad o más recibieron placebo. De estos, en el momento del análisis, 19.067 (9531 COVID-19 mRNA Vaccine BNT162b2 y 9536placebo) se evaluó la seguridad 2 meses después de la segunda dosis de COVID-19 mRNA Vaccine BNT162b2.
Las características demográficas fueron generalmente similares con respecto a la edad, sexo, raza y etnia entre los participantes que recibieron COVID-19mRNA Vacuna y los que recibieron placebo. En general, entre los participantes que recibieron la vacuna COVID-19mRNA BNT162b2, el 51,5% eran hombres y el 48,5% mujeres, el 82,1% eran blancos, el 9,6% eran negros o afroamericanos, el 26,1% eran hispanos / latinos, el 4,3% eran asiáticos y el 0,7% eran Nativo americano / nativo de Alaska.
Las reacciones adversas más frecuentes en los participantes de 16 años o más fueron dolor en el lugar de la inyección (> 80%), fatiga (> 60%), dolor de cabeza (> 50%), mialgia (> 30%), escalofríos (> 30%). %), artralgias (> 20%) y pirexia (> 10%) y generalmente eran de intensidad leve o moderada y se resolvían pocos días después de la vacunación.
Si fuera necesario, tratamiento sintomático con analgésicos y / o antipiréticos (p. ej. Se pueden utilizar productos que contienen paracetamol)
Reacciones adversas de estudios clínicos
Las reacciones adversas notificadas en estudios clínicos se enumeran en esta sección según la clasificación de órganos del sistema MedDRA, en orden decreciente de frecuencia y gravedad. La frecuencia se define de la siguiente manera: muy frecuentes (≥1 / 10), frecuentes (≥1 / 100 a <1/10), poco frecuentes (≥1 / 1.000 a <1/100), raras (≥1 / 10.000 a < 1 / 1.000), muy raras (<1 / 10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Trastornos de la sangre y del sistema linfático
Poco frecuentes: linfadenopatía
Trastornos del sistema nervioso
Muy frecuentes: cefalea
Trastornos musculoesqueléticos y del tejido conjuntivo
Muy frecuentes: artralgia; mialgia
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes: dolor en el lugar de la inyección; fatiga, escalofríos; pirexia
Frecuentes: enrojecimiento en el lugar de la inyección; Hinchazón en el lugar de inyección
Poco frecuentes: malestar
Trastornos gastrointestinales
Frecuentes: Náuseas
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento después de la autorización. Permite un seguimiento continuo de la relación beneficio / riesgo del medicamento.
Se solicita a los profesionales sanitarios que notifiquen cualquier sospecha de reacciones adversas
a través del sitio de notificación de la Tarjeta amarilla de coronavirus https://coronavirus-yellowcard.mhra.gov.uk/ o busque la tarjeta amarilla de MHRA en Google Play o Apple App Store e incluya la marca de la vacuna y el lote / Número de lote si está disponible.
4.9 Sobredosis
Los participantes que recibieron 58 microgramos de la vacuna de ARNm de COVID-19 en ensayos clínicos no informaron un aumento en la reactogenicidad o eventos adversos. En caso de sobredosis, se recomienda el monitoreo de las funciones vitales y el posible tratamiento sintomático.
5. PROPIEDADES FARMACODINÁMICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: {grupo}, código ATC: aún no asignado
Mecanismo de acción
ARN mensajero modificado con fenucleósido en la vacuna de ARNm de COVID-19 La vacuna BNT162b2 está formulada en nanopartículas lipídicas, que permiten la liberación del ARN en las células huésped para permitir la expresión lenta de CoV. 2 antigen.
La vacuna provoca tanto anticuerpos neutralizantes como respuestas inmunitarias celulares al antígeno pico (S), que puede contribuir a la protección contra la enfermedad COVID-19.
Eficacia en participantes de 16 años de edad y mayores
La eficacia de la vacuna de ARNm de COVID-19 BNT162b2 se evaluó en participantes de 16 años de edad o más en dos estudios clínicos llevados a cabo en Estados Unidos, Europa, Turquía, Sudáfrica y América del Sur. El estudio 1 reclutó a 60 participantes, de 18 a 55 años de edad. El estudio 2 es un estudio de eficacia multicéntrico controlado con placebo en participantes de 12 años de edad o más. La aleatorización se estratificó por edad: de 12 a 15 años, de 16 a 55 años o de 56 años o más, con un mínimo del 40% de los participantes en el estrato de ≥56 años.
El estudio excluyó a los participantes inmunodeprimidos y a los que tenían un diagnóstico clínico o microbiológico previo de la enfermedad COVID-19. Se incluyeron participantes con enfermedad estable preexistente, definida como enfermedad que no requirió cambios significativos en la terapia u hospitalización por empeoramiento de la enfermedad durante las 6 semanas antes de la inscripción, al igual que los participantes con infección estable conocida por el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis C (VHC). ) o el virus de la hepatitis B (VHB). No hubo ningún requisito para el uso profiláctico de paracetamol o analgésicos.
Las vacunas contra la gripe (influenza) podrían administrarse fuera de una ventana de ± 14 días de las dosis vacunados.
En el Estudio 2, aproximadamente 44,000 participantes de 12 años de edad o mayores fueron asignados al azar por igual y recibieron 2 dosis de COVID-19. Vacuna de ARNm o placebo con un intervalo planificado de 21 días. Los análisis de eficacia incluyeron a participantes que recibieron su segunda vacunación entre 19 y 42 días después de su primera vacunación.
Está previsto realizar un seguimiento de los participantes durante un máximo de 24 meses para evaluar la seguridad y la eficacia frente a la enfermedad COVID-19.
La población para el análisis de la variable principal de eficacia incluyó a 36.621 participantes de 12 años o más (18.242 en el grupo de vacuna de ARNm de COVID-19 y 18.379 en el grupo de placebo) que no tenían evidencia de infección previa con SARS-CoV- 2 a 7 días después de la segunda dosis.
Las características demográficas fueron generalmente similares con respecto a la edad, el sexo, la raza y la etnia entre los participantes que recibieron la vacuna COVID-19mRNA BNT162b2 y los que recibieron placebo. En general, entre los participantes que recibieron la vacuna COVID-19mRNA, el 51,1% eran hombres y el 48,9% eran mujeres, el 82,8% eran blancos, el 8,9% eran negros o afroamericanos, el 26,8% eran hispanos / latinos, el 4,5% eran asiáticos y el 0,6% eran Nativo americano / nativo de Alaska. El 57,2% tenía entre 16 y 55 años, el 42,6% tenía> 55 años y el 21,8% tenía ≥65 años.
Eficacia contra la enfermedad COVID-19
En el momento del análisis del Estudio 2, la información presentada se basa en participantes de 16 años o más. Se realizó un seguimiento de los participantes para detectar la enfermedad COVID-19 sintomática durante al menos 2.214 personas-año para la vacuna de ARNm de COVID-19 y al menos 2.222 personas-año en el grupo de placebo.
Se identificaron 8 casos confirmados de COVID-19 en el grupo de vacuna de ARNm de COVID-19 y 162 casos en el grupo de placebo, respectivamente.
En este análisis, en comparación con placebo, la eficacia de la vacuna BNT162b2 de ARNm de COVID-19 desde la primera aparición de COVID-19 desde 7 días después de la dosis 2 en participantes sin evidencia de infección previa con SARS-CoV-2 fue del 95% (intervalo creíble del 95% del 90,3%). al 97,6%). En participantes de 65 años de edad o más y de 75 años de edad o más sin evidencia de infecciones previas con SARS-CoV-2, la eficacia de la vacuna de ARNm de COVID-19 BNT162b2 fue del 94,7% (intervalo de confianza bilateral del 95% del 66,7% al 99,9%). ) y 100% (intervalo de confianza bilateral del 95% de -13,1% a 100,0%) respectivamente
En un análisis separado, en comparación con placebo, la eficacia de la vacuna de ARNm de COVID-19 desde la primera aparición de COVID-19 desde 7 días después de la dosis 2 en participantes con o sin evidencia de infección previa con SARS-CoV-2 fue del 94,6% (intervalo creíble del 95% del 89,9% al 97,3%).
No hubo diferencias clínicas significativas en la eficacia general de la vacuna en los participantes que estaban en riesgo de padecer COVID-19 grave, incluidos aquellos con una o más comorbilidades que aumentan el riesgo de enfermedad grave por COVID-19 (p. Ej., Asma, IMC ≥30 kg / m2, enfermedad pulmonar crónica, diabetes mellitus, hipertensión)
Los casos confirmados se determinaron mediante la reacción en cadena de la polimerasa con transcripción inversa (RT-PCR) y al menos 1 síntoma compatible con la enfermedad COVID-19 *.
* Definición de caso (al menos 1 de): fiebre, tos nueva o aumentada, insuficiencia de respiración; escalofríos, dolor muscular nuevo o aumentado, nueva pérdida del gusto u olfato, dolor de garganta, diarrea o vómitos.
5.2 Propiedades farmacocinéticas
No aplicable
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según un estudio convencional de toxicidad a dosis repetidas.
No se han completado los estudios en animales sobre la toxicidad potencial para la reproducción y el desarrollo.
6 DATOS FARMACÉUTICOS
6.1 Lista de excipientes
ALC-0315 = (4-hidroxibutil) azanediil) bis (hexano-6,1-diil) bis (2-hexildecanoato), ALC-0159 = 2 – [(polietilenglicol) -2000] – N, N-ditetradecilacetamida,
1,2-Distearoil-sn-glicero-3-fosfocolina,
colesterol,
cloruro de potasio,
dihidrogenofosfato de potasio, cloruro de sodio,
hidrogenofosfato de disodio dihidrato,
sacarosa,
agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez
6 meses a -80 °C a -60 °C.
6.4 Precauciones especiales de conservación
Conservar en congelador a -80 °C a -60 °C
Conservar en recipiente térmico a -90 °C a -60 °C.
Conservar en el envase original para protegerlo de la luz.
Una vez descongelada, la vacuna debe diluirse y utilizarse inmediatamente. Sin embargo, los datos de estabilidad en uso han demostrado que una vez descongelada, la vacuna sin diluir puede almacenarse hasta 5 días entre 2 °C y 8 °C, o hasta 2 horas a temperaturas de hasta 25 °C, antes de su uso. Durante el almacenamiento, minimice la exposición a la luz de la habitación y evite la exposición a la luz solar directa y la luz ultravioleta. Los viales descongelados se pueden manipular en condiciones de luz ambiental.
Después de la dilución, almacenar la vacuna entre 2 °C y 25 °C y utilizar inmediatamente y en un plazo de 6 horas.
La vacuna no contiene conservantes. Deseche la vacuna no utilizada. Una vez diluidos, los viales deben marcarse con la fecha y hora de dilución.
Una vez descongelada, la vacuna no se puede volver a congelar.
6.5 Naturaleza y contenido del recipiente
Concentrado para solución inyectable para 5 dosis en un vial transparente de 2 ml (vidrio tipo I) con un tapón (bromobutilo) y una cápsula de plástico flip-off con precinto de aluminio
Tamaño del envase: 195 viales
6.6 Precauciones especiales de eliminación y otras manipulaciones
Cualquier medicamento no utilizado o material de desecho debe eliminarse de acuerdo con los requisitos locales.
Para obtener instrucciones sobre la preparación de la dosis del medicamento antes de la administración, ver sección 4.2.
7 TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
No procede.
8 NÚMERO (S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
No se aplica
9 FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
No se aplica
10 FECHA DE REVISIÓN DEL TEXTO